2013-02-09 17:06:12

Πειράματα σε ποντίκια δείχνουν ότι είναι αποτελεσματικό ακόμη και ενάντια σε «δύσκολους» όγκους του εγκεφάλου
Ένα μόριο το οποίο μπορεί να θέσει σε λειτουργία τα συστήματα καταστροφής των όγκων του ίδιου του οργανισμού, οδηγώντας μόνο τα καρκινικά κύτταρα στον θάνατο, εντόπισαν ερευνητές του Πολιτειακού Πανεπιστημίου της Πενσυλβάνιας.
Οι ειδικοί αναφέρουν με δημοσίευσή τους στην επιθεώρηση «Science Translational Medicine» ότι το μόριο που ονομάζεται ΤΙC10 ενεργοποιεί το γονίδιο που κωδικοποιεί για την παραγωγή της πρωτεΐνης TRAIL (tumour-necrosis-factor-related apoptosis-inducing ligand). Η πρωτεΐνη αυτή αποτελεί εδώ και καιρό στόχο για τους ερευνητές του πεδίου του καρκίνου οι οποίοι αναζητούν θεραπείες που δεν θα συνδέονται με τις παρενέργειες των συμβατικών θεραπειών.
Μικρότερη τοξικότητα από τη χημειοθεραπεία
«Η ΤRAIL αποτελεί τμήμα του ανοσοποιητικού συστήματός μας: όλα τα άτομα με λειτουργικό ανοσοποιητικό σύστημα χρησιμοποιούν αυτό το μόριο ώστε να αποτρέπεται ο σχηματισμός και η εξάπλωση των όγκων. Ετσι η αύξηση των επιπέδων της πρωτεΐνης δεν θα είναι τόσο τοξική όσο η χημειοθεραπεία» ανέφερε ο Βάφικ Ελ-Ντίρι, ογκολόγος από το Πολιτειακό Πανεπιστήμιο της Πενσυλβάνιας και κύριος συγγραφέας της μελέτης.
Πειράματα έδειξαν ότι το TIC10 είχε ισχυρή επίδραση ενάντια σε πολλούς και διαφορετικούς όγκους, συμπεριλαμβανομένων του μαστού, του λεμφικού συστήματος, του παχέος εντέρου και του πνεύμονα. Το φάρμακο ήταν μάλιστα ιδιαιτέρως αποτελεσματικό στο να προκαλεί κυτταρική απόπτωση (προγραμματισμένο κυτταρικό θάνατο) στο γλοιοβλάστωμα, μια μορφή όγκου του εγκεφάλου η οποία είναι πολύ δύσκολο να αντιμετωπιστεί.
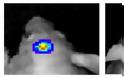
Τρεις εβδομάδες μετά την εμφύτευση όγκων στον εγκέφαλο των ποντικών, όσα πειραματόζωα έλαβαν το πειραματικό φάρμακο (δεξιά) εμφάνισαν σημαντική βελτίωση σε σύγκριση με εκείνα που δεν έλαβαν τη θεραπεία (αριστερά, ο όγκος φαίνεται καθαρά με μπλε χρώμα)
Τριπλάσιος χρόνος επιβίωσης
Ποντίκια με γλοιοβλάστωμα τα οποία έλαβαν TIC10 και bevacizumab – ένα μονοκλωνικό αντίσωμα που χρησιμοποιείται για διαφορετικούς καρκίνους, συμπεριλαμβανομένων καρκίνων του εγκεφάλου – είχαν τριπλάσιο χρόνο επιβίωσης σε σύγκριση με ποντίκια που δεν έλαβαν τη συνδυαστική θεραπεία. Πρέπει ωστόσο να σημειωθεί ότι ο χρόνος επιβίωσής τους ήταν κατά μόλις 6% μεγαλύτερος σε σύγκριση με πειραματόζωα που έλαβαν μόνο bevacizumab.
Σύμφωνα με τον Ελ-Ντίρι, το TIC10 είναι αποτελεσματικό επειδή αποτελεί ένα μόριο πολύ πιο μικρό από τις πρωτεΐνες που έχουν δοκιμαστεί μέχρι σήμερα ως φάρμακα με βάση την TRAIL. Το συγκεκριμένο μόριο έχει την ικανότητα να διαπερνά τον αιματοεγκεφαλικό φραγμό (μια κυτταρική μεμβράνη που προστατεύει τον εγκέφαλο από εν δυνάμει εχθρούς αλλά την ίδια στιγμή αποτρέπει και κάποια χρήσιμα φάρμακα από το να εισέλθουν σε αυτόν). Ο ερευνητής σημείωσε ότι η ομάδα του δεν περίμενε πως το πειραματικό μόριο θα είχε τέτοια αποτελεσματικότητα ενάντια στους όγκους του εγκεφάλου. «Τα αποτελέσματα ήταν μια ευχάριστη έκπληξη» είπε.
Επιπλέον φαίνεται ότι το TIC10 ενεργοποιεί το γονίδιο ΤRAIL όχι μόνο στα καρκινικά κύτταρα αλλά και στα υγιή – έτσι αυξάνεται η ποσότητα των υποδοχέων της TRAIL και στην επιφάνεια των υγιών κυττάρων. Οι υποδοχείς αυτοί μπορούν στη συνέχεια να προσδεθούν στα γειτονικά καρκινικά κύτταρα προκαλώντας τον θάνατό τους.
Άλλες στρατηγικές
Πάντως ο συγκεκριμένος μηχανισμός δεν είναι ο μόνος που πιστεύεται ότι προκαλεί τον θάνατο των καρκινικών κυττάρων. Συγκεκριμένα ερευνητές αναπτύσσουν διαφορετικά φάρμακα, συμπεριλαμβανομένων θεραπειών με βάση την TRAIL, τα οποία δρουν ενεργοποιώντας την πρωτεΐνη p53 (μεταλλαγμένες μορφές αυτής της πρωτεΐνης εμπλέκονται σχεδόν στο 40% των περιπτώσεων καρκίνου). Ωστόσο οι θεραπείες που αφορούν την p53 δεν είναι πάντοτε αποτελεσματικές, εξήγησε ο Ελ-Ντίρι. «Οι περισσότεροι όγκοι φέρουν δυσλειτουργική p53, οπότε για να αναπτύξει κάποιος θεραπείες για τον καρκίνο, πρέπει οι θεραπείες αυτές να είναι αποτελεσματικές σε όγκους με μεταλλαγμένη p53». Η νέα θεραπευτική προσέγγιση του Ελ-Ντίρι και της ομάδας του παρακάμπτει πλήρως την p53.
Οι επιφυλάξεις Παρ' ότι η νέα μελέτη αφορούσε ποντίκια η ερευνητική ομάδα πιστεύει ότι μια παρόμοια προσέγγιση θα ήταν αποτελεσματική και στον άνθρωπο. Αλλοι ερευνητές ωστόσο εμφανίζονται επιφυλακτικοί, εν μέρει επειδή οι στρατηγικές που βασίζονται στην TRAIL δεν έχουν αποδειχθεί ιδιαιτέρως αποτελεσματικές ως σήμερα.
Η θεωρία σχετικά με στόχευση της TRAIL ως νέα προσέγγιση ενάντια στον καρκίνο πρωτοεκφράστηκε στα μέσα της δεκαετίας του 1990. Παρότι οι πρώτες κλινικές δοκιμές θεραπειών με βάση την TRAIL έδειχναν μειωμένη τοξικότητα, δεν ήταν ιδιαιτέρως αποτελεσματικές στη θεραπεία της νόσου, ανέφερε ο Αντριου Θόρμπερν, ογκολόγος από το Πανεπιστήμιο του Κολοράντο στο Ντένβερ, ο οποίος ήταν συγγραφέας μιας ανασκόπησης σχετικά με το ζήτημα η οποία δημοσιεύθηκε πέρυσι. «Ολες οι μεγάλες κλινικές δοκιμές δεν έδειξαν σημαντικά οφέλη επιβίωσης σε ασθενείς που προσέθεσαν θεραπείες με βάση την TRAIL στο συμβατικό θεραπευτικό σχήμα τους» είπε ο ειδικός και προσέθεσε ότι πολλές μεγάλες ομάδες βιοϊατρικής έρευνας έβαλαν τελικώς στην άκρη αυτού του είδους τις θεραπείες.
ΠΗΓΗ
aneksigita-fainomena
Ένα μόριο το οποίο μπορεί να θέσει σε λειτουργία τα συστήματα καταστροφής των όγκων του ίδιου του οργανισμού, οδηγώντας μόνο τα καρκινικά κύτταρα στον θάνατο, εντόπισαν ερευνητές του Πολιτειακού Πανεπιστημίου της Πενσυλβάνιας.
Οι ειδικοί αναφέρουν με δημοσίευσή τους στην επιθεώρηση «Science Translational Medicine» ότι το μόριο που ονομάζεται ΤΙC10 ενεργοποιεί το γονίδιο που κωδικοποιεί για την παραγωγή της πρωτεΐνης TRAIL (tumour-necrosis-factor-related apoptosis-inducing ligand). Η πρωτεΐνη αυτή αποτελεί εδώ και καιρό στόχο για τους ερευνητές του πεδίου του καρκίνου οι οποίοι αναζητούν θεραπείες που δεν θα συνδέονται με τις παρενέργειες των συμβατικών θεραπειών.
Μικρότερη τοξικότητα από τη χημειοθεραπεία
«Η ΤRAIL αποτελεί τμήμα του ανοσοποιητικού συστήματός μας: όλα τα άτομα με λειτουργικό ανοσοποιητικό σύστημα χρησιμοποιούν αυτό το μόριο ώστε να αποτρέπεται ο σχηματισμός και η εξάπλωση των όγκων. Ετσι η αύξηση των επιπέδων της πρωτεΐνης δεν θα είναι τόσο τοξική όσο η χημειοθεραπεία» ανέφερε ο Βάφικ Ελ-Ντίρι, ογκολόγος από το Πολιτειακό Πανεπιστήμιο της Πενσυλβάνιας και κύριος συγγραφέας της μελέτης.
Πειράματα έδειξαν ότι το TIC10 είχε ισχυρή επίδραση ενάντια σε πολλούς και διαφορετικούς όγκους, συμπεριλαμβανομένων του μαστού, του λεμφικού συστήματος, του παχέος εντέρου και του πνεύμονα. Το φάρμακο ήταν μάλιστα ιδιαιτέρως αποτελεσματικό στο να προκαλεί κυτταρική απόπτωση (προγραμματισμένο κυτταρικό θάνατο) στο γλοιοβλάστωμα, μια μορφή όγκου του εγκεφάλου η οποία είναι πολύ δύσκολο να αντιμετωπιστεί.
Τρεις εβδομάδες μετά την εμφύτευση όγκων στον εγκέφαλο των ποντικών, όσα πειραματόζωα έλαβαν το πειραματικό φάρμακο (δεξιά) εμφάνισαν σημαντική βελτίωση σε σύγκριση με εκείνα που δεν έλαβαν τη θεραπεία (αριστερά, ο όγκος φαίνεται καθαρά με μπλε χρώμα)
Τριπλάσιος χρόνος επιβίωσης
Ποντίκια με γλοιοβλάστωμα τα οποία έλαβαν TIC10 και bevacizumab – ένα μονοκλωνικό αντίσωμα που χρησιμοποιείται για διαφορετικούς καρκίνους, συμπεριλαμβανομένων καρκίνων του εγκεφάλου – είχαν τριπλάσιο χρόνο επιβίωσης σε σύγκριση με ποντίκια που δεν έλαβαν τη συνδυαστική θεραπεία. Πρέπει ωστόσο να σημειωθεί ότι ο χρόνος επιβίωσής τους ήταν κατά μόλις 6% μεγαλύτερος σε σύγκριση με πειραματόζωα που έλαβαν μόνο bevacizumab.
Σύμφωνα με τον Ελ-Ντίρι, το TIC10 είναι αποτελεσματικό επειδή αποτελεί ένα μόριο πολύ πιο μικρό από τις πρωτεΐνες που έχουν δοκιμαστεί μέχρι σήμερα ως φάρμακα με βάση την TRAIL. Το συγκεκριμένο μόριο έχει την ικανότητα να διαπερνά τον αιματοεγκεφαλικό φραγμό (μια κυτταρική μεμβράνη που προστατεύει τον εγκέφαλο από εν δυνάμει εχθρούς αλλά την ίδια στιγμή αποτρέπει και κάποια χρήσιμα φάρμακα από το να εισέλθουν σε αυτόν). Ο ερευνητής σημείωσε ότι η ομάδα του δεν περίμενε πως το πειραματικό μόριο θα είχε τέτοια αποτελεσματικότητα ενάντια στους όγκους του εγκεφάλου. «Τα αποτελέσματα ήταν μια ευχάριστη έκπληξη» είπε.
Επιπλέον φαίνεται ότι το TIC10 ενεργοποιεί το γονίδιο ΤRAIL όχι μόνο στα καρκινικά κύτταρα αλλά και στα υγιή – έτσι αυξάνεται η ποσότητα των υποδοχέων της TRAIL και στην επιφάνεια των υγιών κυττάρων. Οι υποδοχείς αυτοί μπορούν στη συνέχεια να προσδεθούν στα γειτονικά καρκινικά κύτταρα προκαλώντας τον θάνατό τους.
Άλλες στρατηγικές
Πάντως ο συγκεκριμένος μηχανισμός δεν είναι ο μόνος που πιστεύεται ότι προκαλεί τον θάνατο των καρκινικών κυττάρων. Συγκεκριμένα ερευνητές αναπτύσσουν διαφορετικά φάρμακα, συμπεριλαμβανομένων θεραπειών με βάση την TRAIL, τα οποία δρουν ενεργοποιώντας την πρωτεΐνη p53 (μεταλλαγμένες μορφές αυτής της πρωτεΐνης εμπλέκονται σχεδόν στο 40% των περιπτώσεων καρκίνου). Ωστόσο οι θεραπείες που αφορούν την p53 δεν είναι πάντοτε αποτελεσματικές, εξήγησε ο Ελ-Ντίρι. «Οι περισσότεροι όγκοι φέρουν δυσλειτουργική p53, οπότε για να αναπτύξει κάποιος θεραπείες για τον καρκίνο, πρέπει οι θεραπείες αυτές να είναι αποτελεσματικές σε όγκους με μεταλλαγμένη p53». Η νέα θεραπευτική προσέγγιση του Ελ-Ντίρι και της ομάδας του παρακάμπτει πλήρως την p53.
Οι επιφυλάξεις Παρ' ότι η νέα μελέτη αφορούσε ποντίκια η ερευνητική ομάδα πιστεύει ότι μια παρόμοια προσέγγιση θα ήταν αποτελεσματική και στον άνθρωπο. Αλλοι ερευνητές ωστόσο εμφανίζονται επιφυλακτικοί, εν μέρει επειδή οι στρατηγικές που βασίζονται στην TRAIL δεν έχουν αποδειχθεί ιδιαιτέρως αποτελεσματικές ως σήμερα.
Η θεωρία σχετικά με στόχευση της TRAIL ως νέα προσέγγιση ενάντια στον καρκίνο πρωτοεκφράστηκε στα μέσα της δεκαετίας του 1990. Παρότι οι πρώτες κλινικές δοκιμές θεραπειών με βάση την TRAIL έδειχναν μειωμένη τοξικότητα, δεν ήταν ιδιαιτέρως αποτελεσματικές στη θεραπεία της νόσου, ανέφερε ο Αντριου Θόρμπερν, ογκολόγος από το Πανεπιστήμιο του Κολοράντο στο Ντένβερ, ο οποίος ήταν συγγραφέας μιας ανασκόπησης σχετικά με το ζήτημα η οποία δημοσιεύθηκε πέρυσι. «Ολες οι μεγάλες κλινικές δοκιμές δεν έδειξαν σημαντικά οφέλη επιβίωσης σε ασθενείς που προσέθεσαν θεραπείες με βάση την TRAIL στο συμβατικό θεραπευτικό σχήμα τους» είπε ο ειδικός και προσέθεσε ότι πολλές μεγάλες ομάδες βιοϊατρικής έρευνας έβαλαν τελικώς στην άκρη αυτού του είδους τις θεραπείες.
ΠΗΓΗ
aneksigita-fainomena
ΦΩΤΟΓΡΑΦΙΕΣ
ΜΟΙΡΑΣΤΕΙΤΕ
ΔΕΙΤΕ ΑΚΟΜΑ
ΠΡΟΗΓΟΥΜΕΝΟ ΑΡΘΡΟ
Έμποροι και φορείς Πύργου: Αποφασισμένοι να "παγώσουν" την πόλη
ΕΠΟΜΕΝΟ ΑΡΘΡΟ
Τσαντάκηδες συνελήφθησαν στο Αγρίνιο
ΣΧΟΛΙΑΣΤΕ